技術資料
USB-PIOの紹介: 生葉への光の影響の測定
I. はじめに
SECMが導入されて間もなく、Leeらによって植物の研究への応用が実証されました[1]。数年後には、SECMが生きた植物の研究にも使用できることが示されました[2]。これらの研究以降、SECMは数多くの植物の研究に使用されてきており[3]、特に植物の気孔活動の研究に有効なことが証明されています[2-4]。
植物の気孔(図1)は、光合成のためのCO2の取り込みと、副産物であるO2およびH2Oの放出を調節する役割を果たしています。気孔の開閉に影響する多くの要因の一つは光とその強度です。気孔自体は周囲の孔辺細胞によって開閉されます。気孔が開いている時、孔辺細胞は膨らんでおり、周囲のエリアよりも高いトポグラフィとなっています。孔辺細胞は気孔が閉じると緩み、そのトポグラフィは膨らんだ状態の時よりも低くなります[5]。これはSECMを使用して生きた植物の葉への光の影響を調べる際に、2つの異なる影響を検出できます。
(1) O2濃度の変化による電流の変化
(2) 気孔の周囲の表面形状の変化による電流の変化
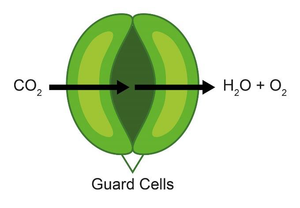
図1: 植物の気孔の概略図。孔辺細胞は気孔を開閉し、CO2を進入させてH2OおよびO2を放出させる
本稿はSECMを使用して青色LED (Light Emitting Diode: 発光ダイオード)のオン/オフの切り替えが生きた植物の葉に与える影響を調査します。
本研究では、一般的な観葉植物であるオリヅルラン (Chlorophytum comosum variegata)の生きた葉が測定されました。LEDのオン/オフ切り替えのために、USB-PIO (Universal Serial Bus – Parallel Input Output: ユニバーサル・シリアル・バス – 並列入出力)アクセサリ(製品番号: U-USB-PIO)が使用されました。USB-PIOを使用することで、一連の実験およびモジュラ―マップ実験の間に青色LEDのオン/オフ切り替えの影響を調査するのが可能になりました。
II. USB-PIOの使用
USB-PIOを図2に示します。これは走査型電気化学ワークステーションのオプションアクセサリで、走査型電気化学ワークステーションのソフトウェア(M470)から低電圧ランプやLEDなどの外部デバイスを切り替えるために設計されています。PCに接続されたUSBポートから電力が供給されます。DB25メス型ピンを備えており、ユーザ・ケーブル、または付属のケーブルおよびブレイクアウトPCBを接続することができます。USB-PIOは最大4つの異なるチャネルを個別にまたは一括して制御するのに使用することができます。

図2: 付属のブレイクアウトPCBに接続されたUSB-PIO。この画像はあくまでも参考例です。ユーザーは、実験セットアップに合わせてブレイクアウトPCBが正しく配置されていることを確認する必要があります。
実験でのUSB-PIOの制御は以下の3つの方法のいずれかで行うことができます。
1. 実験が開かれていない場合、USB-PIOは[Experiment]ドロップダウンメニューの[Parallel I/O] オプションへ、または同オプションからUSB-PIOに書き込むことができます(図3a)。
2. USB-PIOの出力を異なる実験間で切り替えることができる実験シーケンスを書き込むことができます(図3b)。これにより、ユーザーがシーケンスを設定できるあらゆる実験でUSB-PIOを使用できます。
3. dc-SECMベースのモジュラ―マップ実験を行うことができます。この実験では、イベントシーケンスの実行中に、各x-yポイントでUSB-PIOの出力を切り替えたり、入力を読み取ったりすることができます。これは、[Modular]タブの[Sequence of Event]メニューでプログラムします(図3c)。
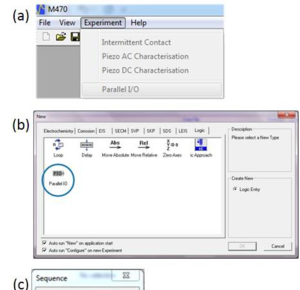
図3: USB-PIOは走査式電気化学ワークステーション・ソフトウェア(M470)で3つの方法のいずれかで制御が可能。
(a) [Experiment]ドロップダウン・メニューからの独立した実験。
(b) 実験シーケンスの[Logic]ステップ。
(c) MMEの間の一連のイベントの一部
モジュラーマップ実験におけるUSB-PIOの使用は、シーケンス実験における使用とは異なり、USB-PIOの各変更の間にエリア全体スキャン実験を実行するのではなく、個々のポイントごとにUSB-PIOへの書き込みまたは読み取りを実行できます。
これによってユーザーは測定された変化がエリア全体スキャン測定中に起こることがあるドリフトやファウリング(fouling:表面に汚れが蓄積・付着して汚染される現象)ではなくUSB-PIOで制御している装置によるものであることを確信することができます。表1は、シーケンス実験とMMEにおけるUSB-PIOの使用を比較したものです。
表1: シーケンスでのUSB-PIOの使用とMMEでの使用の比較
| シーケンスでのUSB-PIOの使用 | MMEでのUSB-PIOの使用 |
|---|---|
| 書き込みのみ | 書き込みおよび読み込み |
| シーケンスに入れることができるいかなる実験でも使用できる | ステップスキャンdc- SECMタイプの実験でしか使用できない |
| 実験の間、USB-PIOチャネルでの変化が適用される | 個々のx-y点でUSB-PIOチャネルでの変化が適用される |
| 単なるUSB-PIOの影響以上のものが見られることがある(熱ドリフトなど) | 期間が短いとUSB-PIOの影響のみが見られる |
このアプリケーション ノートの目的は、シーケンスされた SECM 実験および MME 実験での USB-PIO の使用法を示すことです。
III. 方法
Micro TriCellの底板にビーカーを設置し、Micro TriCellのベース脚と水平になるようにしました。次に、オリヅルランの葉を、植物に付けたままビーカーにセットし、葉の底面が上を向くようにしました。これは、気孔が最も密集している側面である[5]ためです。葉はシリコンチューブリングで固定しました。図4にセットアップの概略図を示します。
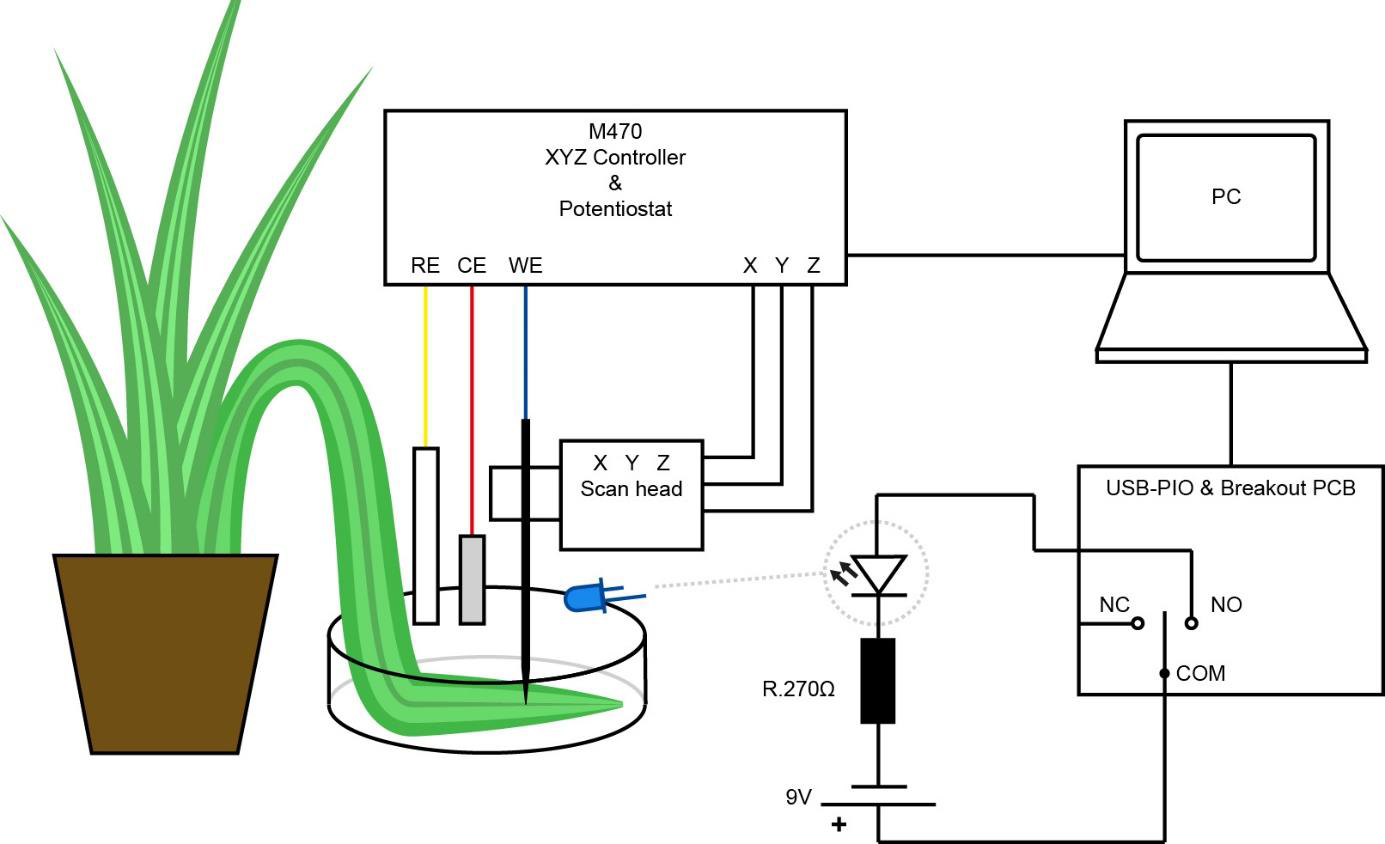
図4: USB-PIOを使用した青色LEDのオン/オフ切り替えの影響を調べるオリヅルランの葉の実験の概略図
SECM測定が直径10μmのPt UMEプローブを使用して0.1 x 10-3 mol L-1 KCl溶液で行われました。電解液中のK+の存在は気孔の閉鎖に影響を及ぼしますが、ここで使用した低濃度は光が依然として気孔の活動に影響を与えることを意味します[6]。
SCE参照電極およびPtシート対極が使用されました。関心のある酸化還元反応は植物の気孔から放出されるO2の還元であるため、Pt UMEは-0.75 V vs. SCEにバイアスされました。測定中のプローブの高さは、周囲光の中の植物へのアプローチカーブによって決定されました。
青色ダイオード光を使用した測定を行う前に、測定領域が適切かどうかを判断するために、まず周囲光でエリアスキャンを実行しました。青色LEDの効果を判断するために実行された測定では、実験に寄与する周囲光がないことを確認するために、スキャンヘッドを不透明なカバーの下に配置しました。
USB-PIOを使用して2つの異なるタイプの実験が行われました。どちらのケースでもUSB-PIOを使用して青色ダイオード(λpeak = 465nm)のオン/オフの切り替えをし、葉を照らしました。LEDは出力1のNCおよびCOMでUSB-PIOに接続されました。このようにLEDを接続すると、実験でチャネル1に書き込みが行われるとLEDが点灯し、チャネル1への書き込みが停止するとLEDが消灯します。必要に応じて、ユーザーはNCの代わりに出力1のNOに接続することもできます。
この場合、チャネル1に書き込まれるとLEDは消灯し、実験でチャネル1への書き込みが行われない時は常に点灯します。同じ前提がすべての出力チャネルに適用されます。最初の実験タイプで、シーケンスはUSB-PIOがLEDを10分間オンにし、SECMエリアスキャンの間オンのままにするように設定されました。このスキャンの終了後、USB-PIOはLEDをオフにしました。
その後、LED がオフのまま次の SECM 領域スキャンを実行するまで 10 分間待機しました。どちらのスキャンも300μm x 300μmのエリアに対してスイープスキャンモードで実行しました。データは3μmの間隔で収集されました。2つ目の実験タイプでは、USB-PIOを6段階のモジュラ―マップ実験の一部として使用し、植物を3時間暗闇状態に置いた後に実行しました。
モジュラ―マップ実験のシーケンスのステップは以下の通りでした。
1. USB-PIOがLEDをオンにしました。
2. プローブが3.000秒間、0V vs. OCPで維持されました。
3. プローブが3.000秒間、-0.75Vでバイアスがかけられました。2.900秒でデータが収集され0.001秒で平均化されました (データ転送速度1000Hz)。
4. USB-PIOがLEDをオフにしました。
5. プローブが3.000秒間、0 V vs. OCPで維持されました。
6. プローブが3.000秒間、-0.75Vでバイアスがかけられました。2.900秒でデータが収集され0.001秒で平均化されました(データ転送速度1000Hz)。
各シーケンスの後、プローブは次のx-y点に移動し、シーケンスを繰り返しました。これは300µm x 300µmの領域を6µm間隔で実行しました。その結果、2つの補完的な領域マップが作成されました。1つは各シーケンスのステップ3で収集されたデータで構成され、もう1つは各シーケンスのステップ6で収集されたデータで構成されます。
最終的な2Dプロットの演算はM470ソフトウェアまたはGwyddion(※プローブ顕微鏡(AFMやSTM)のデータ解析を行うフリーの解析ソフト)[7]を使用して実行されました。得られた2Dエリアマップを3Dマップに変換するために3DIsoPlotが使用されました。
IV. 結果
<IV-1 シーケンスでのUSB-PIOの使用>
USB-PIOは最初、エリアスキャン実験の間に青色LEDをオフに対してオンにする影響を決定するのに使用されました。結果を図5に示します。

図5: LEDがオンおよびオフの状態で行った一連のSECM測定から得られたエリアマップ。
(a) USB-PIOによるエリアスキャンの間、青色LEDがオン。
(b) USB-PIOによるエリアスキャンの間、青色LEDがオフ。
(c) マップ(a)からマップ (b)を引いた結果
この図で、高電流の領域は開いた気孔から出るO2濃度の上昇によるものです。
気孔の周囲の低電流領域は、膨張すると葉の残りの部分よりも隆起する孔辺細胞によるものです。 LEDがオンの状態で行ったスキャンからLEDがオフの状態で行ったスキャンに行くと、気孔で測定された電流が多かれ少なかれ減少するのがわかります。
これは、LED をオンにして測定したマップと LED をオフにして測定したマップを差し引いた図 5c の 3D マップで特に顕著です。
特に顕著なのはマップの中央上部の気孔の変化で、電流がほぼ50%減少しています。LEDがオフの状態で行った測定による気孔の上の電流の減少は、暗闇の中で気孔が閉じることによりO2含有量が減少することと直接関係しています。
図5cはまた、気孔周囲の孔辺細胞上の電流が正になっていることも示しており、LED点灯時にはこれらの細胞の電流値が低いことを示しています。これは、LED点灯時に孔辺細胞が膨張することでトポグラフィが変化(表面が隆起)することを示唆しています。
<IV-2 モジュラ―マップ実験でのUSB-PIOの使用>
青色LEDのオン/オフがオリヅルランから放出されたO2に与える影響は、モジュラ―マップ実験でUSB-PIOを使用することでも調査されました。この実験で作成されたエリアマップを図 6 に示します。

図6: 青色LEDをオン/オフに切り替えるモジュラ―マップ実験でUSB-PIOを使用して得たエリアマップ。
(a) LEDがオンの状態でモジュラ―マップ実験のステップ3の間に測定。
(b) LEDがオンの状態でモジュラ―マップ実験のステップ6の間に測定。
(c) マップ(a)からマップ (b)を引いた結果
元の状態では、LED をオンにした状態で実行した測定と LED をオフにした状態で実行した測定の違いを識別することは困難です。これは、植物の気孔が完全に開いた後、最初は開口部が急激に減少しますが、完全に閉じるまでに数時間かかる可能性があるためと考えられます [6]。そのため、各x-yポイントでの一連のイベントのタイムスケールでは、気孔の開閉に大きな変化は発生しそうにありません。
しかし、LEDがオフの状態で測定されたマップをLEDがオンの状態で測定されたマップから引くと、この変化の影響がはっきりと分かります(図6c)。この図は、青色LEDのオン/オフ切り替えがこの短い時間でもオリヅルランの葉に影響を与えることを示しています。
V. 結論
USB-PIOを用いて青色LEDの点灯と消灯を切り替え、SECMを用いてオリヅルランの気孔開閉への影響を調べました。LEDの点灯と消灯のどちらの場合も、葉の気孔と孔辺細胞に明確な変化が見られることが確認されました。LEDの消灯効果は、モジュラーマップ実験よりもシーケンス実験の方が長期間にわたり顕著でした。
VI. 謝辞
図1および図4のグラフ表示はIan Tindle氏に提供いただきました。
参考文献
- C. Lee, J. Kwak, A. J. Bard, Proceedings of the National Academy of Science USA 87, 5 (1990) 1740-1743
- M. Tsionsky, Z. G. Cardon, A. J Bard, R. B. Jackson, Plant Physiology 113, 3 (1997) 895- 901
- J. Mauzeroll, S. B. Schougaard, in : A. J. Bard, M. V. Mirkin (Ed.), Scanning Electrochemical Microscopy, 2nd Ed., CRC Press, Boca Raton (2012) 379.
- R. Zhu, S. M. Macfie, Z. Ding, Journal of Experimental Botany, 56, 421 (2005) 2831- 2838
- T. Lawson, New Phytologist, 181, 1 (2009) 13-34
- G. D. Humble, T. C. Hsiao, Plant Physiology, 44, 2 (1969) 230-234
- Gwyddionデータ分析ソフトウェア
gwyddion.net
製品情報
- Bio-Logic社電気化学測定システム
- ・ハードウェア
- ・EC-Lab
- ・トラブルシューティング
- ソフトウェア
- ・Zviewおよび東陽テクニカ製ソフトウェア
- 電気化学測定
- ・基礎電気化学
- ・インピーダンス
- ・バッテリー
- ・腐食
- ・その他
- 燃料電池
- ・燃料電池評価







